Àngels González Lafont fué doctora en Ciencias Químicas por la Universidad Autónoma de Barcelona (UAB) en 1989 y profesora de universidad en la UAB en 1992. Catedrática de Química Física en la UAB desde 2011. Directora de 20 Tesis Doctorales (+1 en curso), incluida una con Doctorado Industrial en colaboración con una empresa biotecnológica. Publicación de 169 artículos científicos (+4 en el ámbito de la docencia).
Mi trayectoria científica empezó en el campo de la Química Atmosférica. Utilicé la teoría del estado de transición variacional (VTST), incluidas las correcciones de túnel, para calcular las constantes de velocidad de los procesos químicos significativos de degradación atmosférica iniciados por el radical OH. En 2003, mi investigación evolucionó hacia las simulaciones biomoleculares de catálisis enzimática. Empecé a utilizar simulaciones clásicas de Dinámica Molecular utilizando un modelo completo de las biomoléculas con miles de átomos y moléculas de agua para realizar cálculos QM/MM para estudiar las superficies de energía potencial de diferentes mecanismos catalíticos que me han permitido tener un conocimiento extenso del comportamiento y la reactividad de las ciclooxigenasas y lipoxigenasas.
Mis esfuerzos se centran ahora en el uso de todos mis conocimientos teóricos de las lipoxigenasas (ALOX5, ALOX15 y ALOX12) y COX-2 junto con mi experiencia en metodologías computacionales para modelar sistemas biomoleculares para desarrollar enfoques innovadores de Biomedicina Molecular por bloquear la pro-acción inflamatoria de estas enzimas y activar su función para resolver los procesos inflamatorios que son la causa subyacente de la mayoría de cánceres. El diseño racional de nuevos inhibidores de COX-2 y ALOX5 (la mayoría de fármacos fotocambiables), el diseño biocatalítico de síntesis de MaR1 y el diseño de agonistas es el centro de la investigación que hago actualmente.
Últimas Publicaciones
Protein Science
First-principles simulations of the fluorescence modulation of a COX-2-specific fluorogenic probe upon protein dimerization for cancer discrimination
ACS Catalysis
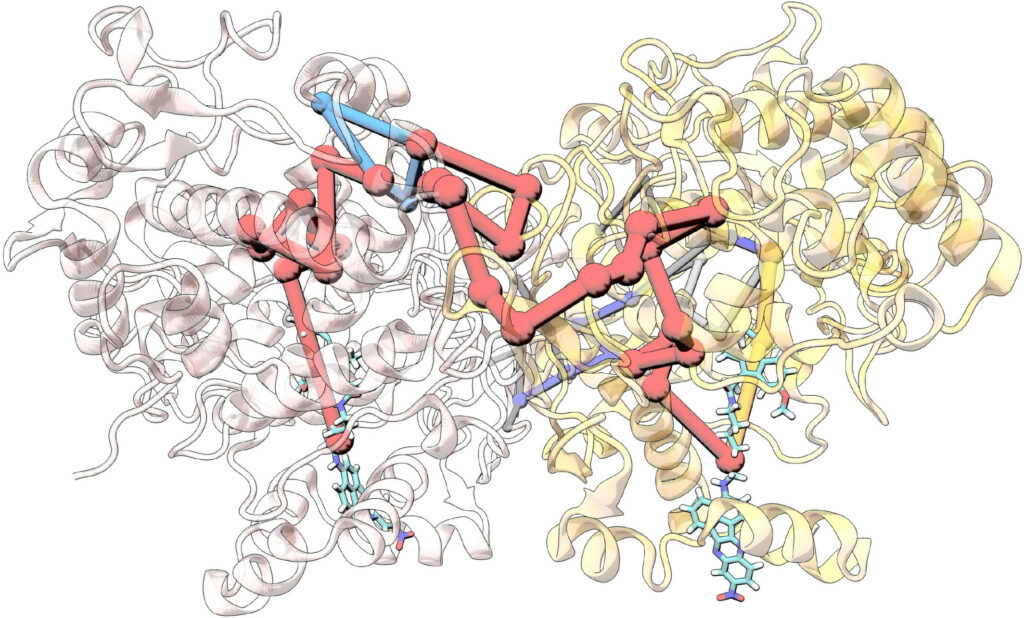
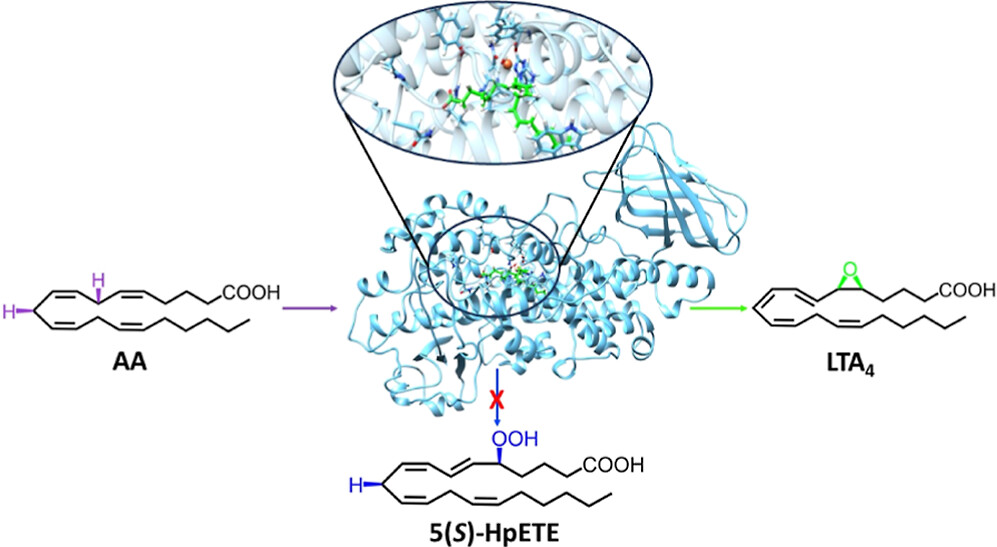
Theoretical Study of the Arachidonic Acid Conversion into Leukotriene A4 Catalyzed by Human 5-Lipoxygenase: Hydroperoxidation and Epoxidation Mechanisms and Arachidonic Acid Active Site Access
Molecules
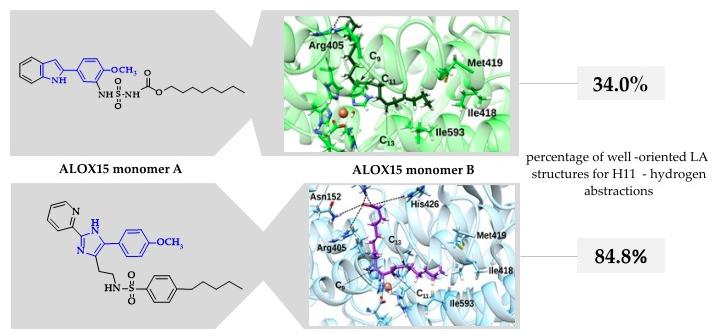
Different Structures—Similar Effect: Do Substituted 5-(4-Methoxyphenyl)-1H-indoles and 5-(4-Methoxyphenyl)-1H-imidazoles Represent a Common Pharmacophore for Substrate Selective Inhibition of Linoleate Oxygenase Activity of ALOX15?